Alquino
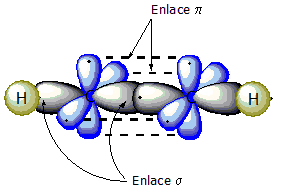
Los alquinos son hidrocarburos alifáticos con al menos un triple enlace (dos enlaces π pi y uno Σ sigma) -C≡C- entre dos átomos de carbono. Se trata de compuestos de ácido metaestables debido a la alta energía del triple enlace carbono-carbono. Su fórmula general es CnH2n-2 .
Para nombrar a los hidrocarburos del tipo alquino se siguen ciertas reglas similares a las de los alquenos.
Ejemplos de alquinos
1) Son insolubles en agua, pero bastante solubles en disolventes orgánicos usuales y de baja polaridad: ligroína, éter, benceno, tetracloruro de carbono.
2) Son menos densos que el agua y sus puntos de ebullición muestran el aumento usual con el incremento del número de carbonos y el efecto habitual de ramificación de las cadenas.
3) Los puntos de ebullición son casi los mismos que para los alcanos o alquenos con el mismo esqueleto carbonado.
4) Los tres primeros términos son gases; los demás son líquidos o sólidos.
5)A medida que aumenta el peso molecular aumentan la densidad, el punto de fusión y el punto de ebullición.
6) Los acetilenos son compuestos de baja polaridad, por lo cual sus propiedades físicas son muy semejantes a la de los alquenos y alcanos.
7) Son inflamables
Hay que tener en cuenta que los acetilenos completen la regla del cuarteto.
Las reacciones más frecuentes son las de adición: de hidrógeno, halógeno, agua, etc. En estas reacciones se rompe el triple enlace y se forman enlaces de menor polaridad: dobles o sencillos.
Los alquinos pueden ser hidrogenas para dar los correspondientes cis-alquenos (doble enlace) tratándolos con hidrógeno en presencia de un catalizador de paladio sobre sulfato de bario o sobre carbonato de calcio (catalizador Lindlar) parcialmente envenenado con óxido de plomo. Si se utiliza paladio sobre carbón activo el producto obtenido suele ser el alcano correspondiente (enlace sencillo).
Aunque la densidad de electrones y con esto de carga negativa en el triple enlace es elevada pueden ser atacados por nucleófilos. La razón se encuentra en la relativa estabilidad del anión de vinilo formado.
Frente al sodio o el litio en amoníaco líquido, se hidrogena produciendo trans-alquenos.
Así como les ocurre a los alquenos, los alquinos participan en otras reacciones de adición:
Dependiendo de las condiciones y de la cantidad añadida de halógeno (flúor, F2; cloro, Cl2; bromo, Br2...), se puede obtener derivados halogenados del alqueno o del alcano correspondiente.
El triple enlace también puede adicionar halogenuros de hidrógeno, agua, alcohol, etc., con formación de enlaces dobles o sencillos. En general se sigue la regla de Markovnikov.
En algunas reacciones (frente a bases fuertes, como amiduro de sodio Na-NH2 en amoniaco NH3) actúan como ácidos débiles pues el hidrógeno terminal presenta cierta acidez. Se forman acetiluros (base conjugada del alquino)que son buenos nucleófilos y dan mecanismos de sustitución nucleófila con los reactivos adecuados. Esto permite obtener otros alquinos de cadena más larga.
En este caso el acetiluro de sodio formado ha reaccionado con bromometano con formación de propino.
La mayor parte de los alquinos se fabrica en forma de acetileno. A su vez, una buena parte del acetileno se utiliza como combustible en la soldadura a gas debido a las elevadas temperaturas alcanzadas.
En la industria química los alquinos son importantes productos de partida por ejemplo en la síntesis del PVC (adición de HCl) de caucho artificial etc.
El grupo alquino está presente en algunos fármacos citostáticos.
Los polímeros generados a partir de los alquinos, los polialquinos, son semiconductores orgánicos y pueden ser dotados parecido al silicio aunque se trata de materiales flexibles y largos.
Los alquinos decolorean una solución ácida de permanganato de potasio y el agua de bromo. Si se trata de alquinos terminales (con el triple enlace a uno de los carbonos finales de la molécula) forman sales con soluciones amoniacales de plata o de cobre (estas sales son explosivas).
El triple enlace entre los carbonos es formado por dos orbitales sp y dos orbitales p. Los enlaces hacia el resto de la molécula se realizan a través de los orbitales sp restantes. La distancia entre los dos átomos de carbono es típicamente de 120 pm. La geometría de los carbonos del triple enlace y sus sustituyentes es lineal.