Desarrollo vegetal
El desarrollo vegetal es el proceso conjunto de crecimiento y diferenciación celular de las plantas que está regulado por la acción de diversos compuestos, dentro de los que se destacan carbohidratos, proteínas, ácidos nucleicos, lípidos y hormonas. Ambos procesos se alternan durante todas las etapas de vida de la planta. A partir del desarrollo del embrión, pasando por la etapa juvenil hasta la planta adulta en donde continuamente se están diferenciando apéndices tales como hojas, flores y frutos. Las investigaciones básicas han establecido la importancia de las fitohormonas, en el proceso de desarrollo vegetal, al inducir respuestas fisiológicas específicas y rápidas del desarrollo cuando se introducen en plantas (ejemplo: inducción de maduración por etileno, caída de hojas con auxinas, estímulo del crecimiento vegetativo por citocininas, etc.). El efecto de varios de los otros compuestos como azúcares, lípidos y vitaminas en el desarrollo vegetal es menos directo, por lo que no tienen alta capacidad para modificar procesos de manera inmediata.
Es la etapa del desarrollo en las plantas que abarca todos los procesos que ocurren justo luego de la fecundación hasta la dormancia o aletargamiento del embrión, que en el caso de las espermatofitas se da dentro de la semilla. Al pasar este tiempo, se establece el plan corporal de la planta: dicho plan corporal es el módulo básico de crecimiento que ha de repetirse conforme la planta crece.
La embriogénesis se da de manera muy similar en todas las angiospermas (además de compartir muchos procesos con el desarrollo embrionario en gimnospermas), pero presenta diferencias en la extensión del desarrollo del endosperma, del desarrollo del cotiledón y la extensión del desarrollo de los meristemas.
La polaridad apicobasal de la planta se establece luego de la primera división en la que se genera una célula basal y una célula terminal (formada cerca del micrópilo) que darán origen al embrión y al suspensor respectivamente. El suspensor es una estructura que al parecer introduce el embrión al tejido gametofítico, además de orientar la superficie de absorción del embrión hacia su fuente de alimento funcionando entonces como un conducto de nutrientes para el embrión en desarrollo. Estas funciones no han sido demostradas pero se sugieren debido a que experimentalmente los embriones con suspensor tienen mayor probabilidad de sobrevivir que los embriones a los que se les remueve. Estudios en Phaseolus coccineus y Arabidopsis, han demostrado que en el estadio de 4 células hay una transcripción diferencial en las células apicales y basales y por lo tanto, los genes son expresados selectivamente en las células del suspensor y del embrión. Sin embargo, hay evidencia genética de que el suspensor tiene la capacidad para desarrollar estructuras embrionarias como ocurre cuando se extirpa la célula apical y como consecuencia, parte del suspensor se diferencia en tejido embrionario.
Conforme el cigoto sufre más divisiones celulares, los patrones radial y axial se van diferenciando. Las células del embrión propiamente dicho, continúan dividiéndose hasta formar una estructura conocida como estadio globular o embrión globular. En este punto se pueden distinguir tres capas celulares: la protodermis, el meristema fundamental y el procambio. La protodermis es el tejido embrionario que da origen al tejido dérmico o epidermis y contribuye a las capas externas que protegen a la planta. Las células que componen la protodemis, solo sufren divisiones anticlinales. Es decir, divisiones perpendiculares a la superficie; el meristema fundamental se ubica por debajo de la protodermis y origina el tejido fundamental que incluye a la corteza y a la médula; finalmente el procambio (también conocido como procambium), se forma hacia el centro del embrión y corresponde al tejido embrionario que dará lugar a los tejidos vasculares del xilema y floema cuya función es de soporte y transporte de fluidos hacia y desde los diferentes apéndices de la planta.
La forma globular del embrión empieza a cambiar conforme las divisiones celulares ocurren y comienzan a formarse los cotiledones. En el caso de las "dicotiledóneas" que tienen dos cotiledones, estos le dan al embrión una forma acorazonada. Hormonas como las auxinas parecen mediar la transición de simetría radial a bilateral. En las monocotiledóneas no se presenta la configuración de embrión acorazonado.
El embrión posee además células que constantemente se están regenerando y que se encargan del crecimiento de la planta tanto en altura como en diámetro; estas células son células madre que componen los tejidos denominados meristemas. En plantas, estos meristemas son:
El papel de los genes extracigóticos en la embriogénesis de plantas es menos claro y hay por lo menos tres fuentes de influencias potenciales: el tejido esporofítico, el tejido gametofítico y el endosperma.
Es la fase postembrionaria del desarrollo de la planta. No todas las plantas germinan luego de que el embrión ha completado su desarrollo; muchas pasan por periodos de latencia en los que el metabolismo se hace más lento, la semilla se deshidrata y los tegumentos se endurecen para proteger al embrión. Hormonas como el ácido abscísico son importantes en el mantenimiento de la latencia y las giberelinas en su ruptura, pues permiten la conversión de almidón en glucosa además condiciones como la humedad, la temperatura, el oxígeno y la luz. Por ejemplo en regiones con climas temperados, muchas semillas necesitan una temperatura de 5 °C para romper la dormancia (Estratificación); mientras que semillas disecadas necesitan la rehidratación (Imbibición).
La germinación se da como producto de interacciones muy evolucionadas entre la semilla y las condiciones del medio que la rodea. Durante la germinación el embrión extrae nutrientes del endosperma o,en algunos casos, de los cotiledones. En monocotiledóneas, el embrión interactúa con el endosperma mediante giberelinas que activan cascadas de señalización que terminan con la ruptura de almidón en azúcar. Los cloroplastos empiezan a diferenciarse tan pronto el tallo alcanza la superficie debido a la exposición a la luz. Elongación de las células forzan a la raíz a salir de la semilla y a dar la anatomía del tallo. Si la elongación se da entre los cotiledones y la radical, es decir en el hipocótilo, los cotiledones son levantados por encima de la superficie del suelo y la plántula es llamada epigea Ej: Arabidopsis. Por el contrario, si la elongación toma lugar entre los cotiledones y el meristema apical, es decir en el epicótilo, los cotiledones se mantienen bajo el suelo y la plántula es llamada hipogea Ej: Haba o Vicia faba (Figura 2)
Las plantas son organismos modulares. Esto implica que su crecimiento ocurre mediante la repetición de módulos. Cada módulo consiste en una hoja con una yema axilar y el punto en donde se insertan las hojas son llamados nudos. Entre nudo y nudo hay un internodo. De esta forma, el crecimiento de las plantas consiste en la repetición de este patrón y en la expresión de las yemas axilares en apéndices reproductivos (flores) o vegetativos (ramas).
El crecimiento en longitud y grosor se da gracias a la acción de los meristemas.
El tamaño de los meristemas es controlado por señales intercelulares mediadas por la acción de genes.
El desarrollo de cada una de las partes de la planta involucra sets diferentes de genes.
La arquitectura y el gestalt de la planta están determinadas por la cantidad de yemas que están presentes y se expresan sobre las axilas de las hojas. La punta del vástago se involucra en un fenómeno denominado "dominancia apical", que consiste en la regulación del patrón de ramificación de la planta por el extremo del vástago. Sobre este punto, las hormonas parecen tener un importante papel en la regulación ambiental de la arquitectura vegetal. Además de la plasticidad ambiental, la arquitectura de la planta está regulada genéticamente.
Algunas hormonas que intervienen en el patrón de crecimiento de las plantas son:
Un tallo consta de nodos (de donde se desprenden las hojas) que están separados por internados y un meristema apical (SAM) en la punta del tallo o sobre el primordio de hoja más joven. En este meristema puede apreciarse tanto estructuras radiales como verticales:
-Zona central: células grandes y de división lenta. En su interior está la zona de costilla que genera las capas centrales del tallo (Figura 3).
-Zona periférica: células más pequeñas y de división rápida. Inicia las hojas, las yemas axiales y las capas externas del tallo (Figura 3).
Se organiza en capas, siendo la más externa la túnica que consta de las capas L1 que origina la epidermis, L2 que origina el mesófilo y L3 que origina los haces vasculares; luego el corpus que son células menos organizadas (Figura 3).
Además puede encontrarse en dicotiledóneas la médula, un meristema que permite el engrosamiento primario. Sam varía de acuerdo a la especie, el estado de desarrollo y las condiciones de crecimiento; por ejemplo, las cícadas tienen el SAM más grande de las plantas vasculares, con 3mm de diámetro, mientras en Arabidopsis mide 50 μm.
Así como en las raíces, la auxina juega un papel en el establecimiento de SAM. En los estados tempranos de la embriogénesis la distribución polar de la proteína PIN1 lleva a la acumulación de auxina en la región apical, más tarde con mediación de la kinasa PINOID y la fosfatasa PP2, esta proteína produce una redistribución de la auxina, llevando a bajos niveles en la zona central. También se ven involucrados factores de transcripción como WUS (en la región subapical del estadio de 16 células), NAC y finalmente STM (en el estadio de corazón); juntos mantienen las células en un estado en que pueden proliferarse y así asegurar que la diferenciación en tejidos del tallo esté balanceada con la producción de nuevas células indeterminadas (Con embriones mutantes se ha visto que la expresión se ve afectada por los niveles y distribución de la auxina). Otro mecanismo que controla este equilibrio está dado por una retroalimentación negativa o negative feedback en la participan los genes y proteínas kinasa CLAVATA 1,2 y 3 (CLV1, 2 y 3) al suprimir la transcripción de WUS; consistente con este modelo, se ha observado que en mutantes clv el tamaño de SAM se incrementa considerablemente, mientras que en mutantes sus la sobreexpresión de CLV3 suprime la actividad de WUS y por tanto el meristema se pierde.
Muchas dicotiledóneas y algunas monocotiledóneas presentan engrosamiento secundario. En monocotiledóneas, grupos de células del parénquima se vuelven meristemáticas produciendo haces vasculares adicionales. En dicotiledóneas, está presente el cámbium vascular que genera tejido vascular secundario con células de rayo y el cámbium corcho que genera una capa protectora: el corcho. El cámbium corcho, el corcho y el parénquima forman el peridermo.
Investigaciones sobre pteridófitas y angiospermas indican que el primordio de hoja más joven visible no está determinado para producir una hoja sino un vástago. El establecimiento del eje dorsoventral es esencial para determinar la forma aplanada característica de la mayoría de las hojas. Para modelar las formas menos conspicuas y más detalladas de estas, muchas veces la planta recurre a estrategias como la apoptosis.
La organización de las hojas o filotaxia puede cumplir tres patrones: alternado, decusado y espiral que dependen de varios factores intrínsecos así como ambientales y mutaciones que llevan al cambio de la forma y tamaño del meristema. Diversas aproximaciones han mostrado evidencia que sitios de iniciación de hojas corresponden a zonas con acumulación de auxina, pues se ve una distribución asimétrica de las proteínas PIN.
La emergencia de una hoja se da a partir del eje radial del meristema apical y su geometría y orientaron depende del desarrollo adecuado de los ejes que la conforman: próximo- distal, adaxial-abaxial y centro-lateral. Las primeras indicaciones para formar el primordio de hoja es la división periclinal en las capas subepidérmicas del SAM creando una protuberancia que define el eje próximo- distal de la futura hoja.
Cuando el primordio de hoja emerge, la superficie que quedará arriba apunta hacia el centro del meristema y es llamada adaxial; la superficie que quedará debajo apunta en contra del centro del meristema y es llamada abaxial. Inicialmente, el crecimiento es simétrico pero luego en este eje se evidencia una asimetría en cuanto al tipo de células como en la epidermis (Ej: estomas y tricomas) y su crecimiento diferencial como en el xilema y el floema. Las hojas se separan del tallo dado que el crecimiento adaxial supera el abaxial. Hay evidencia de que el tejido adaxial promueve la formación de meristemas axiales y mantiene el desarrollo de SAM.
El establecimiento de una superficie adaxial (haz) y una abaxial (envés) está a cargo de un grupo de genes conocidos como PHABULOSA (PHAB), PHAVOLUTA (PHAV), KANADI (KAN), YABBY., PHANTASTICA (PHAN), PINHEAD (PNH) y ARGONAUTE1 (AGO1).
Las proteínas PHAB y PHAV se acumulan en la superficie adaxial de la hoja al ser activadas por un ligando lipídico. Por el contrario, las proteínas KAN y YABBY se acumulan y expresan en el lado abaxial. La proteína KAN activa los genes YABBY. Estos dos grupos de genes (los de expresión adaxial y los de expresión abaxial) restringen la actividad de sus antagonistas. Es decir, PHAB y PHAV restringen la acción de KAN y YABBY a la superficie abaxial, mientras que KAN y YABBY restringen la acción de PHAB y PHAV a la superficie adaxial.
- PHAN: Codifica para factor de transcripción que se expresa en el meristema apical en el lugar de iniciación de la hoja. Es necesario para el desarrollo del eje abaxial-adaxial. En mutantes la hoja pierde el eje y desarrolla simetría radial.
- PNH y AGO1: Necesario para el desarrollo del eje adaxial. Pérdida de función de PNH hace que el genotipo de "ago1" sea más severo. PNH es expresado más fuertemente en la parte adaxial del primordio más joven P1 y en el segundo primordio más joven P2 es únicamente expresado en el lado adaxial.
- PHAB: Se restringe a la región adaxial de P2. hojas phab tienen forma redonda o de trompeta dado que carecen de lámina y solo la epidermis adaxial queda rodeando la hoja.
- YABBY: Necesario para el desarrollo del eje abaxial. La expresión inicia en las células subepidérmicas del I2, luego en P1 se restringe a la epidermis y el mesófilo esponjoso y desaparece en la hoja madura.
- LAM1: Mantiene el eje adaxial-abaxial. mutantes lam1 muestran un desarrollo normal hasta P2, sin embargo y a pesar de que se inició una lámina, células adaxiales son reemplazadas por células abatibles.
Este eje se hace visible en el estadio P3 y su desarrollo es basipétalo, al igual que el transporte de auxina. Se ve influenciado por el gen KN1 de la familia de genes KNOX, necesarios en la iniciación y desarrollo del meristema apical; es silenciado en la zona de iniciación de las hojas. EL modelo se basa en una ganancia de función, es decir, una proteína está presente donde normalmente está ausente. En la región proximal de la hoja se experimenta una alta concentración de morfógenos que hacen que se adopte una forma de hoja, mientras en la región distal la concentración de morfógenos es menor y por tanto se da un destino de borde.
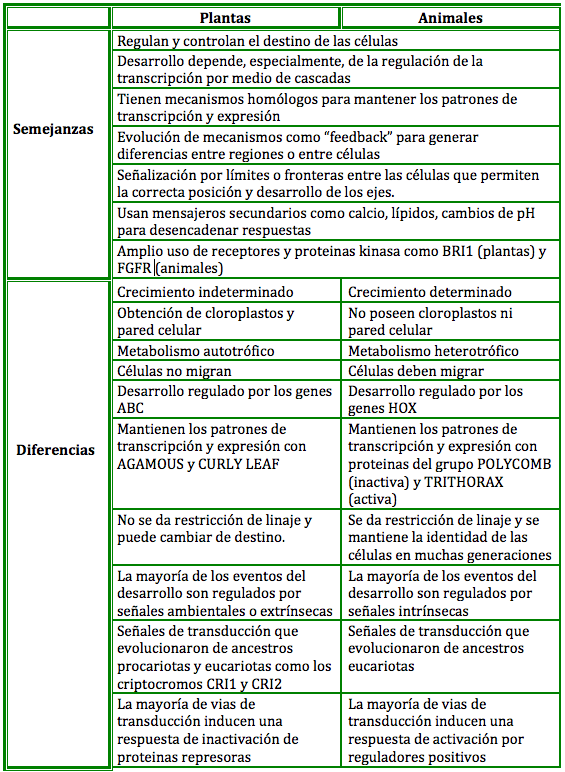
Las plantas se diferencian fácilmente de los animales por sus características morfológicas, relacionadas con patrones de desarrollo. El ancestro común, descrito como un eucarionte que poseía mitocondrias y metabolismo aerobio, sistema endomembranoso (aparato de Golgi, citoplasma compartimentalizado y vesículas para endocitosis y exocitosis), citoesqueleto con actina y tubulina, receptores celulares que permitían responder a señales ambientales y cambiar la expresión de genes y capacidad de realizar división mitótica y meiótica existió hace mil millones de años. Todas estas características fueron heredadas por los progenitores de los reinos animal y vegetal con la diferencia de la obtención de cloroplastos, metabolismo autotrófico y pared celular por parte de las plantas,.
Se han encontrado gran variedad de genes que desempeñan importantes papeles en la regulación del crecimiento, la diferenciación celular y los patrones de formación en las plantas, usando como modelo de estudio a Arabidopsis. Después de la secuenciación del genoma de Arabidopsis y de estudios relacionados con la función de cada uno de sus genes se han logrado gran cantidad de avances en este campo. En la mayoría de los estudios, los genes importantes para el desarrollo han sido encontrado mediante elaboradas búsquedas en la descendencia de plantas a las que se les realizan procesos de mutagénesis. Los esfuerzos se han concentrado en mapear, clonar y secuenciar genes mutantes.
En estos momentos de la historia y gracias a los avances en la Biología del Desarrollo en plantas, los cuales han usado estudios de genética molecular acoplados con análisis clonales, biología celular, estudios bioquímicos y fisiológicos se han encontrados importantes genes involucrados que codifican para factores de transcripción o para componentes de las diferentes vías de señalización. Aunque aún se está lejos de entender por completo el mecanismo usado por las plantas para la regulación de las vías de desarrollo algunas aproximaciones hasta el momento incluyen:
Los factores de transcripción son proteínas que presentan una alta afinidad por el ADN y que son capaces de activar la expresión génica. Después de la secuenciación del genoma de Arabidopsis se descubrió que su genoma codificaba para aproximadamente 26 000 genes de los cuales alrededor 1500 codifican para factores de transcripción. Estos 1500 factores de transcripción pertenecen a numerosas familias de genes, algunas de las cuales solo han sido encontradas en plantas y la mayoría en eucariotas. Dentro de las familias de genes involucradas con el desarrollo en plantas las más estudiadas y de las que más se tiene información hasta el momento son las cajas MADS y los genes Homeobox.
Genes de las cajas MADS:
Son claves en la regulación de importantes procesos biológicos tanto en plantas como en animales y hongos. Dentro del genoma de Arabidopsis se encuentran aproximadamente 30 genes MADS involucrados en aspectos para el control del desarrollo en las raíces, hojas, óvulos y frutos. Estos genes son expresados en una manera restringida de forma espacial y temporal restringida y su expresión está determinada por eventos de señalización. Una de las funciones más importantes de esta familia es el desarrollo de la identidad floral.
Genes Homeobox:
Codifican para un homeodominio de proteínas que actúan como factores de transcripción, las cuales desempeñan un importante papel en la regulación de las vías del desarrollo en todos los eucariotas. Las proteínas del homeodominio pertenecientes a la clase KNOTTED1 (KN1) están involucrados en el mantenimiento de la indeterminación en el meristemo apical del tallo. La mutación kn1 ha sido encontrada en maíz y produce una expresión anormal de genes y la ganancia de función.
En la mayoría de los organismos vivos las células en los diferentes tipos de tejidos se producen clonalmente de una misma célula madre. Sin embargo, en plantas, la evidencia soporta la idea de que el destino celular no depende del linaje celular sino que es determinada por la posición. En la mayoría de los casos las células epidérmicas de las raíces se derivan de un pequeño grupo de células madre en la capa L1. Sin embargo, los derivativos de la capa L1 están comprometidos a ser células epidérmicas debido a que se encuentran posicionadas en la parte superior de la capa celular cortical y no porque se derivan clonalmente de las células madre en la capa L1.
El plano en el cual una célula se divide determinará la posición de la célula hija dentro de un tejido y esta posición determinará el destino de esta célula. La más fuerte evidencia que se tiene de la importancia de la posición, consiste en experimentos realizados en los cuales se examina el destino de células que son desplazadas de su posición normal a otra (mover grupos de células de una capa a otra). Las divisiones en las capas L1 y L2 son anticlinales y este tipo de división es la responsable de las capas iniciales.
A pesar de que el entendimiento del papel de las redes génicas en el control de las vías del desarrollo, muchos descubrimientos apuntan a un modelo en el cual eventos de señalización a larga distancia controlan la expresión de genes que codifican para factores de transcripción. Estos factores de transcripción van a determinar el carácter o actividades de una célula o tejido dado. Estos mecanismos además, pueden involucrar “ feed-back loops” en los cuales dos o más genes interactúan regulando la expresión de otros. Estas interacciones de genes en las redes génicas han sido encontradas en el meristemo apical del tallo.
Si el destino celular está determinado por la posición y no por el linaje, estas deben ser capaces de saber su posición relativa con respecto a otras células, tejidos y órganos. Las células, tejidos y órganos adyacentes proveen esta información posicional. Las células en plantas multicelulares se encuentran en contacto estrecho con otras cerca de ellas, coordinando cuidadosamente el comportamiento que cada célula debe seguir dentro de un órgano o tejido. La coordinación de la actividad celular requiere de la comunicación célula-célula, lo cual requiere a su vez de importantes genes. La comunicación célula-célula ocurre por al menos tres mecanismos: