SNARE (proteína)
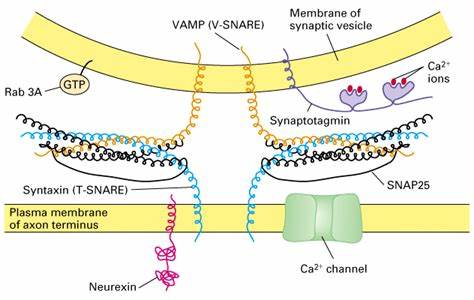
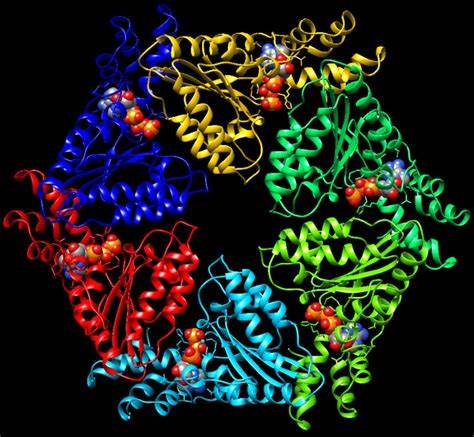
Las proteínas SNARE —acrónimo derivado de su nombre en inglés 'SNAP (Soluble NSF Attachment Protein) REceptor'— o receptores de proteínas de fijación soluble de NSF son un grupo de proteínas cuyo papel principal es facilitar la fusión de las vesículas, encargadas del transporte de moléculas necesarias para el funcionamiento de las célula, con los compartimentos celulares apropiados. Se trata de una familia de proteínas grande, con al menos 24 miembros presentes en las levaduras y más de 60 en los mamíferos.
Las SNARE más estudiadas son las que median el acoplamiento de las vesículas sinápticas con la membrana presináptica en las neuronas.
Las proteínas SNARE pueden ser divididas en dos tipos. Las v-SNARE —donde la 'v' denota 'vesícula'— se incorporan a las membranas de las vesículas de transporte durante su formación en el compartimento celular de origen. Las t-SNARE —la 't' significa target, palabra inglesa que designa el compartimento terminal o «diana»— están asociadas con las membranas del compartimento celular de destino. Las investigaciones realizadas sugieren que las t-SNARE forman subcomplejos estables que sirven como guías para la unión de las v-SNARE para así formar el complejo SNARE. Varias proteínas SNARE se encuentran tanto en las vesículas como en las membranas diana, por lo que un esquema de clasificación más reciente toma en cuenta las características estructurales de las SNARE, dividiéndolas en R-SNARE y Q-SNARE. A menudo, las R-SNARE actúan como las v-SNARE y las Q-SNARE como las t-SNARE. Las R-SNARE se caracterizan por aportar una arginina (R) en la formación del núcleo del complejo SNARE. Entre las R-SNARE se encuentra la sinaptobrevina, localizada en las vesículas sinápticas. Las Q-SNAREs contribuyen una glutamina (Q). Las Q-SNARE incluyen la sintaxina y la SNAP-25. Las Q-SNARE se pueden clasificar a su vez como Qa, Qb o Qc, dependiendo de su ubicación en el complejo.
Las SNARE son proteínas abundantes, con una estructura bastante simple. Constan de un motivo característico o motivo SNARE compuesto por seis o siete decenas de aminoácidos dispuestos en héptadas repetitivas. La mayoría tiene un único dominio transmembranal conectado al extremo carboxilo de la cadena polipeptídica que conforma el motivo SNARE, y varios dominios aminoterminales. Existen excepciones como la brevina, sin dominios adicionales en el extremo amino, y la SNAP-25, que carece de dominio transmembranal pero que se une a la membrana por palmitoilación en la región conectora entre sus dos motivos SNARE.
Las SNARE pueden anclarse a la membrana plasmática y a las membranas del retículo endoplásmico, las mitocondrias, y los peroxisomas, aunque cada SNARE diferente se acopla solo con una membrana en particular. La adaptación de las SNARE a su membrana diana se logra mediante diferencias en los aminoácidos que rodean el extremo carboxilo o en la longitud del doiminio transmembrana. La sustitución del dominio transmembrana por lípidos conduce a una fase intermedia de la fusión de las bicapas lipídicas de las membranas, en la que las capas en contacto se fusionan, pero no las dos capas distales.

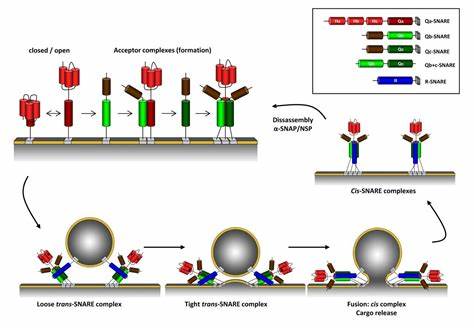
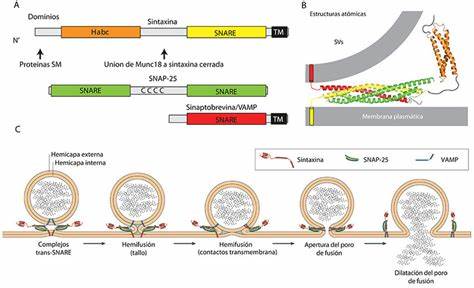
Las v- y t-SNARE se unen para formar un complejo en el que los dominios SNARE se disponen en un apretado haz de cuatro hélices, conocido como complejo trans-SNARE. En las vesículas sinápticas, estos complejos «trans» son extremadamente estables y se componen de tres SNARE: sintaxina y SNAP-25, ancladas a la membrana celular y sinaptobrevina —también conocida como proteína de membrana asociada a vesículas o VAMP— asociada a la membrana de la vesícula. La sinaptobrevina y sintaxina contribuyen una hélice cada una, mientas que SNAP-25 contribuye con dos, denominadas Sn1 y Sn2. Las cadenas laterales de los aminoácidos en el núcleo del complejo SNARE forman 16 capas o anillos, numerados desde -7, en el extremo amino, hasta +8, en el extremo carboxilo. Estas capas presentan carácter hidrofóbico, excepto la capa 0, en la posición central del complejo, compuesta por una arginina (R) —procedente de la sinaptobrevina— que interactúa con tres glutaminas (Q) aportadas por la sintaxina, Sn1 y Sn2 respectivamente.
Las capas de aminoácidos hidrofóbicos que flanquean la capa 0 actúan como una tapadera impermeable que la protege de las interacciones iónicas con el solvente circundante. La rotura de esta protección impermeable y la consiguiente desestabilización del complejo tras unirse al factor sensible a la N-etilmaleimida (NFS) forma parte el mecanismo de descomposición y reciclaje de los complejos SNARE después de la finalización de la exocitosis de las vesículas sinápticas.
Se ha demostrado que las SNARE localizadas en la membrana plasmática se agrupan en microdominios, cuya integridad es crítica para el proceso de exocitosis de la célula.
La fusión de membranas es una serie de acontecimientos que requieren energía para superar las fuerzas electrostáticas de repulsión entre las membranas, la interrupción de la bicapa lipídica y la reformación de una nueva membrana. Las proteínas SNARE generan energía a través interacciones proteína-lípidos y proteína-proteína, que actúan como una fuerza impulsora para la fusión de membrana.
Aunque en un principio se pensaba que la fusión de membranas se iniciaba por la disociación del complejo SNARE mediante el factor sensible a la N-etilmaleimida (NSF), posteriormente se concluyó que es el ensamblaje del complejo lo que constituye el primer paso del proceso, en el que las proteínas v-SNARE y t-SNARE presentes en las dos membranas a fusionar se combinan para formar el complejo trans-SNARE. Durante la fusión, el complejo pasa a adquirir una configuración «cis», en la que todas las proteínas SNARE participantes se encuentran ancladas a la misma membrana. El complejo cis-SNARE es inactivo, y su reciclaje requiere consumo de energía en forma de ATP. El NSF disocia el complejo a través de los cofactores conocidos como SNAP o proteínas de fijación soluble de NSF. Tras la unión de tres moléculas de SNAP, el NSF puede actuar sobre el complejo y posibilitar la disponibilidad de las proteínas SNARE para las reacciones de fusión futuras.
La adopción de la configuración trans entre las proteínas SNARE localizadas en las dos membranas destinadas a fusionarse es fundamental para generar la fuerza necesaria para aproximar las dos membranas. El ensamblaje del complejo tiene lugar mendiante el entrecruzamiento de las hélices que conforman los motivos SNARE desde el extremo amino hacia el carboxilo, comparable al cierre de una cremallera. El proceso de ensamblaje está limitado por el dominio SNARE de la sintaxina, que habitualmente se encuentra unida a la proteína Munc18 en una conformación que la imposibilita interactuar con otras proteínas SNARE. Se cree que la sintaxina adopta una configuación «abierta» favorable a la formación del complejo cuando la proteína Munc13 en complejo con RIM desaloja a la Munc18 tras la hidrólisis de una molécula de GTP unida a un las proteínas Rab3A y RIM.
También se ha sugerido que la Munc18 actúa como un catalizador de la fusión, permaneciendo asociada con el péptido N-terminal de la sintaxina para después volverse a unir al complejo SNARE de cuatro hélices recién formado. Este posible mecanismo de disociación y reasociación con los dominios SNARE podría depender de la presencia de calcio.
Se piensa que la fuerza necesaria para juntar las dos membranas durante su fusión surge del cambio conformacional de los complejos SNARE de «trans» a «cis». Cuando se forma el complejo trans-SNARE, las proteínas v-SNARE y t-SNARE todavía se encuentran en las membranas opuestas. Parte de la energía liberada durante la formación de la superhélice del complejo SNARE es almacenada como tensión mecánica en las zonas semirrígidas que conectan los dominios transmembrana con el complejo SNARE. Esta flexión energéticamente desfavorable se reduce al mínimo cuando la vesícula y la membrana celular se alinean con el complejo SNARE; de este modo, la reducción de la tensión supera la barrera energética de repulsión entre las membranas y sus superficies se juntan.
Los siguientes pasos en el proceso de fusión consisten en la formación de una estructura lipídica en forma de tallo entre las membranas adyacentes y su consiguiente expansión y transformación en un poro de fusión. Existen varias hipótesis sobre estos procesos, aunque su naturaleza exacta y el papel que desempeñan las proteínas SNARE es objeto de debate. Algunos autores piensan que las SNARE no solo ponen las membranas en contacto, sino que promueven la expansión del poro de fusión hasta formar el Porosoma. Los extremos hidrofóbicos de los lípidos que conforman la capa exterior de una de las membranas pueden insertarse en la membrana vecina cuando esta se encuentra a una distancia de un nanómetro. Se sospecha que el dominio transmembrana de las SNARE contribuye al acercamiento, quizá produciendo un abultamiento local de la membrana, porque el tallo no se forma cuando este dominio es reemplazado por lípidos. Una vez formado el tallo, la tensión mecánica del complejo SNARE provoca su expansión y la penetración de la zona carboxilo-terminal, cargada negativamente, en la membrana puede contribuir también a la apertura del poro.
Para disociar el complejo cis-SNARE es necesario un aporte de energía por hidrólisis de ATP mediante el NSF. El NSF es una ATPasa de la superfamilia de las AAA+ o ATPasas Asociadas a diversas Actividades). El NSF no se une directamente a las proteínas SNARE, sino que actúa por medio de su cofactor alpha-SNAP. Se precisan varios ciclos catalíticos para desmontar el complejo SNARE. Este proceso permite la recaptación de la sinaptobrevina para su uso posterior en las vesículas, mientras que las otras proteínas SNARE permanecen asociadas a la membrana celular.
La inversión de energía para disociar los complejos SNARE asegura que una vez que se desencadena la fusión de vesículas, el proceso se lleva a cabo de forma espontánea y con una velocidad óptima. Un procedimiento comparable tiene lugar en los músculos, en los que las cabezas de miosina deben hidrolizar ATP para adoptar la conformación necesaria para la interacción con la actina y la consiguiente contracción muscular.
La proteína Q-SNARE asociada al sinaptosoma (SNAP-25) consta de dos dominios alpha-helicoidales conectados por un segmento sin estructura secundaria definida que contiene cuatro cisteínas. Los dominios helicoidales SNARE se combinan con los de la sintaxina y sinaptobrevina para formar el complejo SNARE.
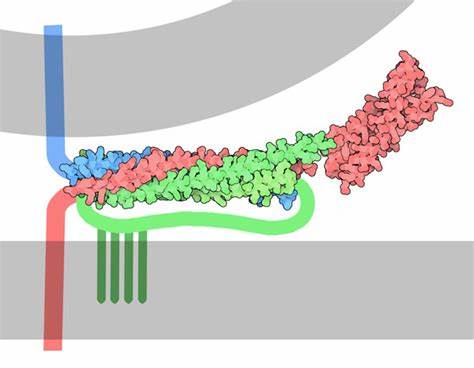
Mientras que tanto la sintaxina como sinaptobrevina contienen dominios transmembrana que permiten su acoplamiento con la membrana diana y la membrana de la vesícula respectivamente, SNAP-25 depende de la palmitoilación —enlace covalente de ácidos grasos a cisteínas— para el anclaje a la membrana de la vesícula. Algunos estudios sugieren que la asociación de SNAP-25 con la sintaxina a través de interacciones SNARE hace innecesarios tal mecanismo de acoplamiento. Sin embargo, los experimentos con sintaxina inactivada mediante modificación genética no han hallado una disminución en la unión de SNAP-25 a la membrana, lo que sugiere que el medio de conexión directo existe. La unión de las cadenas de ácidos grasos a una o varias cisteínas de SANP-25 regula el acoplamiento y la exocitosis mediada por las proteínas SNARE. La palmitoilación está catalizada por una enzima especializada llamada DHHC palmitoil transferasa. El dominio rico en cisteína de la SNAP-25 también se asocia débilmente con la membrana plasmática, lo que posiblemente le permita ser localizada cerca de la DHHC palmitoil transferasa para su palmitoilación. El proceso inverso se lleva a cabo mediante otra enzima llamada palmitoil proteína tioesterasa o PPT.
Es posible que la disponibilidad de la proteína SNAP-25 para formar el complejo SNARE esté regulada por la localización de microdominios de lípidos en la membrana diana: Según esta teoría, las cisteínas palmotoilizadas podrían ubicarse en una región determinada de la membrana destino gracias a un entorno lipídico apropiado —posiblemente con abundancia de colesterol— complementarios a las cadenas de ácidos grasos unidos a los residuos de cisteína de la SNAP-25.
Cuando un impulso eléctrico llega al axón terminal, la despolarización consiguiente estimula la apertura de los canales de calcio dependientes de voltaje (VGCC) y la rápida entrada de calcio siguiendo el gradiente electroquímico. El calcio estimula la exocitosis mediante su unión con la sinaptotagmina 1. Se ha demostrado que la SNAP-25 disminuye la densidad de corriente a través de los VGCC y, en consecuencia, la cantidad de calcio enlazado a la sinaptotagmina y la exocitosis neuronal; en cambio, la subexpresión de SNAP-25 aumenta la densidad de corriente en el VGCC y estimula la exocitosis.
Como la mayoría de las proteínas SNARE, la sintaxina consiste de tres dominios: el dominio transmembrana C-terminal, el dominio SNARE, que se acopla a la SNAP-25 y a la sinaptobrevina, y un dominio N-terminal. El dominio N-terminal, denominado dominio Habc, consta de tres hélices alfa y tiene la capacidad de doblarse sobre sí mismo y asociarse con el dominio SNARE formando una configuración «cerrada» que impide la formación del complejo SNARE y funcionando así como un autoinhibidor de la sintaxina. Cuando el dominio Habc se disocia del dominio SNARE, este queda libre para unirse a la SNAP-25 y la sinaptobrevina. Se cree que la proteína Munc-18 puede estabilizar tanto la conformación cerrada como el complejo SNARE-trans.
Existe una inmensa diversidad de subtipos de sintaxina, con quince variedades halladas en el genoma humano. Se ha sugerido que la sintaxina 1B tiene un papel en la regulación del número de vesículas sinápticas disponibles para la exocitosis en el axón terminal o depósitos de vesículas para liberación inmediata. Un estudio de 2014 demostró que la inactivación de la sintaxina 1B reduce el tamaño de estas concentraciones de vesículas.
Muchas neurotoxinas interfieren directamente con el complejo SNARE; las toxinas botulínica y tetánica, por ejemplo, impiden el reciclaje de vesículas y provocan la pérdida de control muscular, espasmos, parálisis e incluso la muerte.
La toxina botulínica (BoNT) es una de las toxinas más potentes jamás descubiertas. Es una enzima proteolítica que degrada las proteínas SNARE en las neuronas. La toxina consta de dos subunidades, denominadas cadena pesada (100kDa) y una cadena ligera (50kDa), unidas por un enlace disulfuro. BoNT actúa mediante un mecanismo de cuatro etapas: la unión a la membrana neuronal, la endocitosis, la translocación de la membrana, y la proteólisis de las proteínas SNARE. En la primera etapa, la cadena pesada de BoNT se une a los gangliósidos y proteínas de la membrana de las neuronas presinápticas. A continuación, la toxina se introduce en la membrana celular (endocitosis). La cadena pesada experimenta un cambio conformacional sustancial para la translocación de la cadena ligera en el citosol de la neurona. Finalmente, una vez que la cadena ligera se encuentra en el citosol, se disocia de la cadena pesada por la reducción del enlace disulfuro, mediada por el complejo NADPH-tiorredoxina reductasa- tiorredoxina; la cadena ligera de BoNT actúa como una metaloproteasa que depende de los iones de Zn (II), y escinde las proteínas SNARE, lo que impide la exocitosis.
Hay ocho isotipos conocidos de BoNT, BoNT/A-H, que escinden las proteínas SNARE en diferentes sitios. Los isotipos A, C, y E actúan sobre la SNAP25 e impiden la formación del complejo SNARE. BoNT C también disocia la sintaxina, con efectos similares. Los isotipos B, D y F, a su vez, atacan a la sinaptobrevina en las neuronas sinápticas. En todos estos casos, la neurotoxina botulínica impide la fusión de las vesículas sinápticas a la membrana sináptica y la liberación de los neurotransmisores en la hendidura sináptica. Esto impide de propagación de los impulsos que estimulan las células musculares, causando parálisis y, en casos graves, la muerte. Aunque los efectos de la neurotoxina botulínica pueden ser letales, también se ha utilizado como agente terapéutico en algunos tratamientos médicos y cosméticos.
La toxina tetánica o TeNT se compone de una cadena pesada (100 kDa) y una cadena ligera (50 kDa) unidas por un enlace disulfuro. La cadena pesada es responsable de la unión neuroespecífica de TeNT a la membrana terminal nerviosa, la endocitosis de la toxina, y la translocación de la cadena ligera en el citosol celular. La cadena ligera tiene una actividad endopeptidasa dependiente de cinc o metaloproteinasa matriz (MMP) responsable de la escisión de la sinaptobrevina.
Para la activación de la cadena ligera de TeNT, es necesario que un átomo de cinc esté enlazado a cada molécula de la toxina. En la presencia de cinc, la reducción del enlace disulfuro tiene lugar principalmente a través del sistema redox NADPH-tiorredoxina reductasa-tiorredoxina, las lo que la cadena ligera puede romper el enlace Gln76-Phe77 de la sinaptobrevina. La escisión de la sinaptobrevina afecta la estabilidad del núcleo SNARE, que no puede adoptar la conformación de baja energía que permitre la unión a la NSF. La escisión de la sinaptobrevina por la neurotoxina, incluso a dosis bajas, es la causa de la inhibición de la exocitosis de los neurotransmisores.
Los neurotransmisores se almacenan en los depósitos de vesículas disponibles para liberación inmediata, confinadas dentro de la terminal presináptica. Durante la neurosecreción, las proteínas SNARE participan en el acoplamiento de vesículas, la fusión, y la sincronización de la liberación de los neurotransmisores en la hendidura sináptica. Cuando las vesículas entran en contacto físico con la membrana, la sintaxina 1A, previamente inhibida por Munc-18, queda libre para unirse a las proteínas v-SNARE. Tras la asociación transitoria de las proteínas v y t-SNARE sin mediación del calcio, se forma el complejo SNARE y las vesículas se unen a la membrana presinápticas, en lo que se conoce como la zona activa. Los canales de calcio dependientes del voltaje se concentran en torno a las zonas activas. La entrada de calcio es detectada por sinaptotagmina 1, que desencadena de forma muy rápida el paso final de la fusión de la vesícula con la membrana presináptica.
Se ha investigado la posible relación entre la expresión anormal de SNAP-25 y una variedad de trastornos neuronales. Por ejemplo, los polimorfismos en el locus del gen SNAP-25 se han asociado a la manifestación del trastorno por déficit de atención con hiperactividad o ADHD. Asimismo, se ha demostrado una correlación entre el nivel de expresión de la SNAP-25 y la aparición de la esquizofrenia.
La macroautofagia es un proceso catabólico durante el que se forman orgánulos de doble membrana llamados autofagosomas que contribuyen la degradación de los componentes celulares de desecho mediante la fusión con lisosomas. Los autofagosomas se forman por la encapsulación de parte del citoplasma por una estructura denominada fagogoro, compuesto por una doble membrana en forma de copa. Durante un tiempo se pensó que los fagoforos se originaban por una adición de novo de lípidos, pero experimentos publicados en 2011 apuntan al origen de los lípidos en otras membranas de la célula, como las del retículo endoplásmico, el aparato de Golgi, la membrana plasmática, y las mitocondrias.
Las proteínas SNARE tienen un papel importante en la fusión de vesículas en la formación del fagoforo. Aunque se desconoce el mecanismo de formación de los fagoforos en los mamíferos, se cree que las proteínas SNARE participan en este proceso a través de la fusión homotípica de pequeñas vesículas de membrana simple, revestidas de clatrina, que contienen la proteína relacionada con la autofagia 16-1 (o ATG16L1), la v-SNARE VAMP7 y las t-SNARE sintaxina 7, sintaxina 8 y VTI1B. En la levadura, las t-SNARE Sec9p y Sso2p son necesarias para la exocitosis y ara la formación de vesículas con ATG9, también requerida para la biogénesis autofagosomal. La inactivación de cualquiera de esas SNARE conduce a la acumulación de vesículas incapaces de fusionarse y dar lugar al fagoforo.
Las SNAREs también son importantes en la mediación de la fusión del autofagosoma y el lisosoma. En los mamíferos, las SNARE VAMP7, VAMP8, y VTI1B son necesarias para este proceso, limitado por ciertos trastornos de almacenamiento lisosomal, en los que el colesterol se acumula en los lisosomas y retiene las SNARE, impidiendo así su reciclaje. En 2012, se descubrió que la sintaxina 17, una SNARE asociado al autofagosoma que interactúa con VAMP8 y SNAP29 es también necesaria para la fusión con el lisosoma. La sintaxina 17 se localiza en la membrana externa de los autofagosomas, pero no en los fagoforos y otros precursores autofagosomales, y les impide a estos la fusión prematura con el lisosoma. En la levadura, la fusión de los autofagosomas con las vacuolas precisa de SNARE tales como la sintaxina VAM3, SNAP-25, VAM7, la Ras-GTPasa YPT7, y la SEC18, un ortólogo de la NSF.
Escribe un comentario o lo que quieras sobre SNARE (proteína) (directo, no tienes que registrarte)
Comentarios
(de más nuevos a más antiguos)
Aún no hay comentarios, ¡deja el primero!